
Wie man die anabole Kraft des Zellvolumens nutzt

Intensives Training aktiviert die Proteinsynthese, aber nur, wenn die richtige Ernährung vorhanden ist, um sie zu unterstützen. Wenn Sie den Artikel lesen, den John Meadows und ich mit dem Titel Maximize Protein Synthesis geschrieben haben, oder wenn Sie etwas gelesen haben, was T Nation seit Jahren zu diesem Thema sagt, sind Sie wahrscheinlich mit dem Konzept des „anabolen Fensters“ und der Bedeutung vertraut der Peri-Workout-Ernährung.
Was in den Stunden nach dem Training auf zellulärer Ebene passiert, sagt langfristige Gewinne voraus. Nutzen Sie dieses „anabole Fenster“ und Sie werden wachsen wie nie zuvor. Vermisse es immer wieder und wünsche dir viel Glück.
Die richtigen Makronährstoffe zur richtigen Zeit zu erhalten, ist der Schlüssel, aber Makros sind nur ein Teil des Gesamtbildes. Ein wichtiger, aber oft übersehener Aspekt der Muskelproteinsynthese ist das Zellvolumen. Das Zellvolumen ist nicht nur kosmetisch. Es ist der Haupttreiber des Aminosäuretransports und arbeitet auch hinter den Kulissen, um die Proteinsynthese einzuschalten und den Proteinabbau zu unterdrücken.
Zellenvolumen: Das fehlende Glied
Ein voller / voluminöser Muskel ist ein anaboler Muskel. Während wir seit über 20 Jahren wissen, dass Zellschwellungen den Proteinabbau hemmen und die Proteinsynthese in bestimmten Zellen stimulieren (1-3), war der Mechanismus, der das Zellvolumen mit der Proteinsynthese verbindet, bis vor kurzem ein Rätsel.
Was wir jetzt wissen, ist, dass die Proteinsynthese durch das Enzym mTOR gesteuert wird, das durch mechanischen Stress, Wachstumsfaktoren und Leucin aktiviert wird.
Während alle drei für den Trainingsreiz wichtig sind, hängt die mTOR-Signalübertragung auch vom Zellvolumen ab.(4) Dies ist besonders wichtig im Skelettmuskel, wo die Zellvolumisierung die Glykogen- und Proteinsynthese aktiviert und den Proteinabbau hemmt.(5, 6)
Der wissenschaftliche Durchbruch, der zum Zusammenhang zwischen Zellvolumen und Proteinsynthese führte, erfolgte 2005, als eine Gruppe von Wissenschaftlern entdeckte, dass zur Aktivierung von mTOR-Glutamin mehr als nur Leucin erforderlich ist.(7)
Das war eine Überraschung. Obwohl Glutamin als eine „bedingt essentielle“ Aminosäure angesehen wird, die den Proteinabbau bei schwerem Trauma oder Stress begrenzt, war es nie mit der Aktivierung von mTOR in Verbindung gebracht worden.
Glutamin war für die Leucinaufnahme und die Zellvolumisierung notwendig, die beide benötigt werden, um die Proteinsynthese einzuschalten. Die Autoren zeigten weiter, dass zelluläres Glutamin Erschöpfung Dies führt nicht nur zu einer Verringerung des Zellvolumens, sondern verringert auch die Fähigkeit von Leucin, die Proteinsynthese zu aktivieren.(7)
Diese Entdeckung war riesig, da sie einen direkten Zusammenhang zwischen Glutamin, Zellvolumen und Proteinsynthese herstellte. Zum ersten Mal wurde gezeigt, dass Glutamin für die Aktivierung der Proteinsynthese durch Leucin notwendig ist.
Imbiss aus dieser Studie:
- Glutamin wird benötigt, damit Leucin Zugang in die Zelle erhält, um die Proteinsynthese einzuschalten.
- Glutamin-induzierte Zellvolumisierung ist notwendig, um die mTOR- und Proteinsynthese einzuschalten.
Während diese Studie darauf hinwies, dass Glutamin ein sehr wichtiger Teil des Puzzles ist, der Zellvolumen und Proteinsynthese verbindet, wurde der genaue Mechanismus erst 2009 herausgearbeitet, als Nicklin et al. entdeckte, dass der Glutaminexport an den Leucinimport und die mTOR-Aktivierung gekoppelt ist.(8)
Um Leucin in die Zelle zu bringen, gibt es eine anfängliche Phase der „Glutaminbeladung“.Dies zieht auch Wasser an und erhöht das Zellvolumen. Nach der Phase der „Glutaminbeladung“ wird Glutamin im Austausch für den Import von Leucin aus der Zelle exportiert.
Nicklin et al. entdeckte auch, dass zelluläre Glutaminspiegel für die Aktivierung der Proteinsynthese durch Leucin geschwindigkeitslimitierend sind. Wenn die Zellen gleichzeitig mit Glutamin und einer Leucin enthaltenden EAA-Mischung behandelt wurden, wurde die Aktivierung der Proteinsynthese um 60 Minuten verzögert. Wenn diese gleichen Zellen mit Glutamin "vorbeladen" waren, wurde die Proteinsynthese innerhalb von 1-2 Minuten nach Gabe von Leucin an die Zellen eingeschaltet.
Dieses Ergebnis war wichtig, da es die Verzögerungszeit für die Aktivierung der Proteinsynthese durch Leucin in diesem experimentellen Modell erklärte.
Imbiss aus dieser Studie:
- Glutamin ist eine Geschwindigkeitsbegrenzung für die Leucinaktivierung der Proteinsynthese.
- Eine Zelle muss mit Glutamin vorbeladen sein, um Leucin importieren zu können.
Diese Ergebnisse werfen schließlich ein Licht auf die zelluläre Maschinerie, die den Aminosäuretransport reguliert, und wie sie an die Kontrolle der Proteinsynthese gekoppelt ist.
Diese Arbeit muss jedoch mit einer gewissen Vorsicht interpretiert werden. Eine wichtige Einschränkung dieser Studien war, dass sie in vitro durchgeführt wurden (d.h.e. in Zellkulturen), wo die Regulation oder Proteinsynthese viel einfacher ist. Muskelzellen sind in der Lage, Glutamin nach Bedarf aus anderen Aminosäuren herzustellen, und die „Glutaminverarmung“ in diesem Zellkulturmodell ist nicht repräsentativ für physiologischere Situationen in vivo.
Hohe Proteinsyntheseraten können im Muskelgewebe mit oder ohne Glutamin-Supplementierung nicht unbegrenzt aufrechterhalten werden. Glutamin kann jedoch verwendet werden, um die Proteinsynthese strategisch zu unterstützen, indem das Zellvolumen während der Zeit nach dem Training optimiert wird.

Tertiärer aktiver Transport (TAT): Wie Leucin in die Zelle gelangt
Zellen sind sehr beschäftigt und es gibt viele membrangebundene Ionenkanäle und Transporterproteine, die den Verkehr in und aus der Zelle regulieren. Es gibt insbesondere zwei Klassen von Aminosäuretransportern, die hier wichtig sind: Die Aminosäuretransporter "System L" und "System A" sind am engsten mit der mTOR-Signalübertragung und der Proteinsynthese verbunden.(8-10)
Die Aktivität der System A- und System L-Transporter ist gekoppelt, wodurch Leucin und die anderen BCAAs in die Zelle absorbiert werden können.(11) System L-Transporter sind für den Zufluss von Leucin und den anderen BCAAs im Austausch für den Abfluss von Glutamin verantwortlich.
System A-Transporter arbeiten jedoch über einen anderen Mechanismus, bei dem Glutamin an die Natriumaufnahme gekoppelt ist.(12, 13) Die Kopplung zwischen Natriumaufnahme und System L / System A-Aminosäuretransportern wird als tertiärer aktiver Transport (kurz TAT) bezeichnet. Es ist TAT, das letztendlich Leucin in die Zelle treibt, was zur Aktivierung von mTOR und zur Proteinsynthese führt.(11)
Wie TAT funktioniert, sehen Sie in der folgenden Abbildung:
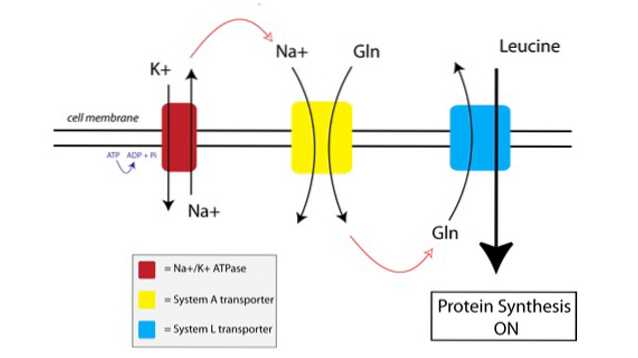
Erstens verwendet eine membrangebundene Pumpe, die als Natrium-Kalium-ATPase-Pumpe bezeichnet wird (Na + / K + ATPase, in der obigen Abbildung rot), Energie aus ATP, um Natrium gegen seinen Konzentrationsgradienten außerhalb der Zelle zu bewegen.
Die erhöhte Natriumkonzentration außerhalb der Zelle ist an den Import von Glutamin durch den System A-Transporter gekoppelt (in der Abbildung gelb). Der Zufluss von Glutamin und Natrium in die Zelle zieht auch zusätzliches Wasser ein, wodurch die Zelle anschwillt. Dies versetzt die Zelle in einen anabolen Zustand und bereitet die Proteinsynthesemaschinerie auf die Aktivierung vor.
Wenn sich Glutamin in der Zelle auf ausreichend hohe Werte aufbaut, werden die System L-Transporter (in der Abbildung blau) aktiviert, die das Glutamin im Austausch gegen die Leucinaufnahme außerhalb der Zelle transportieren. Der Eintritt von Leucin in die Zelle ist der Auslöser für die Proteinsynthese.
Während dies bisher eine großartige Lektion in Biochemie war, ist die Entdeckung von TAT nicht nur für Zellbiologen wichtig. Jetzt, da wir wissen, wie das Zellvolumen an den Aminosäuretransport und die Proteinsynthese gekoppelt ist, können wir verschiedene Ernährungsstrategien entwickeln, um den Prozess zu maximieren, wenn er zählt - während der kritischen Zeit nach dem Training.
Strategie 1: Holen Sie sich hydratisiert
Die Proteinsynthese ist völlig abhängig von der Zellhydratation - wenn Sie auch nur ein wenig dehydriert sind, ist die Fähigkeit, sich von intensivem Training zu erholen, völlig beeinträchtigt. Viel Wasser zu bekommen ist hier ein Kinderspiel, aber Wasser allein reicht nicht aus.
Elektrolyte wie Natrium, Kalium, Chlorid und Phosphat fungieren auch als „Osmolyte“, da sie Wasser in die Zelle ziehen. Nach einer intensiven Trainingseinheit benötigen wir Wasser, Aminosäuren und Elektrolyte, um den Zellvolumisierungsprozess zu maximieren, der die Proteinsynthese antreibt.
Natrium, Magnesium, Kalzium, Kalium, Phosphat und Chlorid (um nur einige zu nennen) sind hier alle wichtig. Scheuen Sie sich auf einem minimalen Niveau (es sei denn, Sie tun dies auf Anraten Ihres Arztes) nicht vor Natrium vor oder nach dem Training. Wenn Sie an Natriummangel leiden, ist Ihre Pumpe aus dem Training fast nicht mehr vorhanden, und Natrium ist für die Glutaminaufnahme erforderlich.
Um das Rätselraten zu vermeiden, wurden Surge® Workout Fuel und Plazma ™ mit idealen Elektrolytverhältnissen entwickelt, um das Zellvolumen und die Proteinsynthese zu unterstützen.
Strategie 2: Glutaminbeladung
Die Aufnahme von Glutamin in die Zelle führt zu einer Volumenbildung der Zellen und bereitet die Muskelzellen auf die Proteinsynthese vor. Wie bereits erwähnt, ist ein voll / voluminöser Muskel ein anaboler Muskel. Neben dem Antrieb des Aminosäuretransports erhöht die Zellvolumisierung auch die Glykogensynthese und hemmt den Proteinabbau.(4-6)
Die Proteinsynthese wird durch Glutaminmangel unterdrückt, was enorme Auswirkungen auf hart trainierende Sportler hat. Nach einer intensiven Trainingseinheit wird eine Entzündungsreaktion ausgelöst, die es den Immunzellen ermöglicht, in verprügeltes Muskelgewebe zu gelangen, um mit dem Reparatur- / Wiederaufbauprozess zu beginnen.(14)
Glutamin wird von Immunzellen so schnell aufgenommen, dass es als „Treibstoff des Immunsystems“ gilt.(15) Es ist nicht überraschend, dass intensives Training zu einem Glutaminmangel im Plasma führt.(16-18)
Aus diesem Grund steigt der Glutaminbedarf in der Zeit nach dem Training, in der die lokale Immunantwort möglicherweise um die Verfügbarkeit von Glutamin konkurriert, um Muskelzellen für die Aminosäureaufnahme und Proteinsynthese vorzubereiten.
Vorladen Zellen mit Glutamin können möglicherweise auch die mit der Leucinaktivierung der Proteinsynthese verbundene „Verzögerungszeit“ verringern. Wenn Sie dies noch nicht tun, nehmen Sie unmittelbar nach dem Training 10-15 g Glutamin oder Glutaminpeptide ein. Da BCAAs ein weiteres beliebtes Substrat für die Muskelglutaminsynthese sind und nachweislich auch die Muskelglutaminproduktion erhöhen (19-21), sind BCAAs und Leucin auch während der Zeit vor dem Training nützlich, um die endogene Glutaminproduktion zu maximieren.
Anmerkung des Herausgebers: Das gesamte Plamza / MAG-10-Protokoll mit seiner Ernährung vor dem Training, Training und nach dem Training erfüllt die Empfehlungen des Autors zum Laden der Muskeln mit BCAAs und Leucin.
Strategie 3: Ansaugen der Pumpe
Kürzlich wurde entdeckt, dass der Verbrauch von EAAs die Expression sowohl von System A- als auch von System L-Aminosäuretransportern erhöht.(9) Wichtig ist, dass dies auf der „posttranskriptionellen Ebene“ geschieht, dh auf der Ebene der Proteinsynthese, wo vorhandene mRNAs in Proteine übersetzt werden.
Vergleichen Sie dies mit „denovoDie Proteinexpression - bei der die Synthese, Verarbeitung und der Transport neuer mRNAs 16 oder mehr Stunden dauern kann - kann nach der Transkription in wenigen Minuten bis Stunden aktiviert werden, sodass die Zellen bei Bedarf den Spiegel bestimmter Proteine schnell erhöhen können.
Plötzlich haben wir einen größeren Anreiz, einen soliden Ernährungsplan für das Peri-Workout aufzustellen. Die EAA-Aufnahme während der Perioden vor und nach dem Training zahlt sich nach dem Training aus, indem die Expression von Aminosäuretransportern erhöht wird und die Zelle auf maximale Aminosäureaufnahme vorbereitet wird und Aktivierung der Proteinsynthese.
Ideal sind hier schnell absorbierende Proteinisolate oder -hydrolysate wie Mag-10® Protein Pulsing Protocol ™ oder Plazma ™ während der Zeit vor und nach dem Training.
Strategie 4: Die Insulinverbindung
Insulin ist das anabolste Hormon im Körper. Neben der direkten Aktivierung der Proteinsynthese erhöht Insulin auch die Translokation der Aminosäuretransporter des Systems A zur Zellmembran.(22)
Dies bedeutet, dass Insulin dazu führt, dass mehr System A-Transporter auf der Zellmembran angezeigt werden, die bereit sind, mehr Glutamin in die Zelle zu treiben. Mehr Glutamin führt zu mehr Zellvolumen, was mehr Leucin in die Zelle treibt und letztendlich zu mehr Proteinsynthese führt.
Während EAAs die erhöhen Ausdruck Bei AA-Transportern ist es das Insulinsignal, mit dem sie auf der Zelloberfläche angezeigt werden können, um neue Aminosäuren in die Zelle zu transportieren.
Dies ist ein weiterer Grund, warum Kohlenhydrate vor und nach dem Training eine gute Idee sind, es sei denn, Sie befinden sich im extremen Fettabbau: Insulin erhöht die Kapazität für den zellulären Aminosäuretransport.
Strategie Nr. 5: Insulin-potenzierende Aminosäuren
Kohlenhydrate erhöhen den Insulinspiegel, aber bestimmte Aminosäuren können auch zur Potenzierung der Insulinfreisetzung verwendet werden. Glutamin ist ein starker Aktivator von „Inkretin“ -Hormonen, die insulinproduzierende Zellen in der Bauchspeicheldrüse empfindlicher auf Glukose machen.(23) Glycin potenziert auch die Insulinfreisetzung durch einen anderen Mechanismus.
Obwohl Kohlenhydrate nach dem Training allein den Insulinspiegel erhöhen, wird durch die Kombination dieser insulinpotenzierenden Aminosäuren mit Kohlenhydraten die Bauchspeicheldrüse für eine noch stärkere Insulinfreisetzung aufgeladen. Während es gut ist, den Insulinspiegel die meiste Zeit auf der unteren Seite zu halten, maximieren erhöhte Insulinspiegel während des Peri-Workout-Zeitraums den Aminosäuretransport, das Zellvolumen und die Proteinsynthese und unterdrücken gleichzeitig den Proteinabbau.
Strategie 6: Pufferlaktatproduktion mit Beta-Alanin
Die Art des intensiven anaeroben Trainings, das erforderlich ist, um eine Menge hochwertiger Muskeln aufzubauen, führt zu einer beträchtlichen Laktatproduktion, die den pH-Wert der Muskeln senkt. Dies führt zu frühzeitiger Muskelermüdung und -schwäche, aber auch bestimmte Aminosäuretransporter, einschließlich System A, werden durch einen niedrigen pH-Wert gehemmt.(13)
Wenn der Muskel-pH niedrig ist, wird die Aminosäureaufnahme verringert, was die mTOR-Aktivierung der Proteinsynthese unterdrückt.(24) Es wurde auch gezeigt, dass eine Hemmung der Aminosäuretransporter des Systems A bei niedrigem pH-Wert den Proteinabbau erhöht.(25)
Hier kommt Beta-Alanin ins Spiel. Erhöhte Carnosinspiegel in den Muskeln wirken als natürlicher Säurepuffer und verlängern die anaerobe Schwelle, indem sie die Abnahme des Muskel-pH-Werts während des Trainings begrenzen.
Beta-Alanin hat eine weitere wichtige Funktion: Es hilft, die Proteinsynthese aufrechtzuerhalten und sie nach intensivem Training schneller online zu stellen, indem die Abschwächung des Aminosäuretransports verhindert wird.
Nehmen Sie dreimal täglich zwei Tabletten Beta-7 ™ ein, um den Carnosinspiegel der Muskeln zu erhöhen.
Einpacken
Während intensiver Trainingseinheiten wird die Proteinsynthese reduziert und der Proteinabbau aktiviert. Dies ist für jeden hart trainierenden Lifter unvermeidlich. Das Ausmaß, in dem wir die katabolen Auswirkungen des Trainings minimieren können und je schneller wir während des Zeitraums nach dem Training in den „anabolen Modus“ zurückkehren können, bestimmt letztendlich, wie effizient wir uns erholen - und wachsen.
Das Timing von Makronährstoffen ist wichtig, aber es ist ein Mittel zum Zweck. Das Zellvolumen ist der Haupttreiber des Aminosäuretransports und der Proteinsynthese. Wenn wir verstehen, wie der Aminosäuretransport abläuft und wie er durch das Zellvolumen reguliert wird, können wir schneller mehr Leucin in zerstörte Muskelzellen bringen, wodurch das anabole Feuer geschürt wird und letztendlich zu besseren Gewinnen führt.
Die oben genannten Strategien sind effektiv, praktisch und basieren auf den neuesten wissenschaftlichen Erkenntnissen. Verwenden Sie sie als Vorlage, um Ihren Trainingsfortschritt auf die nächste Stufe zu bringen.
Ich freue mich auf Ihre Fragen zur LiveSpill!
Verweise
- Haussinger D., Hallbrucker C., vom DS, Decker S., Schweizer U., Lang F. et al. Das Zellvolumen ist eine Hauptdeterminante für die Proteolysekontrolle in der Leber. FEBS Lett 1991; 283: 70 & ndash; 2.
- Haussinger D, Hallbrucker C, vom DS, Lang F, Gerok W. Zellschwellung hemmt die Proteolyse in perfundierter Rattenleber. Biochem J 1990; 272: 239 & ndash; 42.
- Stoll B, Gerok W., Lang F., Haussinger D. Leberzellvolumen und Proteinsynthese. Biochem J 1992; 287 (Pt 1): 217 & ndash; 22.
- Schliess F, Richter L, vom DS, Haussinger D. Zellhydratation und mTOR-abhängige Signalübertragung. Acta Physiol (Oxf) 2006; 187: 223 & ndash; 9.
- Low SY, Rennie MJ, Taylor PM. Beteiligung von Integrinen und des Zytoskeletts an der Modulation der Glykogensynthese der Skelettmuskulatur durch Veränderungen des Zellvolumens. FEBS Lett 1997; 417: 101 & ndash; 3.
- Low SY, Rennie MJ, Taylor PM. Signalelemente, die an Aminosäuretransportreaktionen auf verändertes Muskelzellvolumen beteiligt sind. FASEB J 1997; 11: 1111 & ndash; 7.
- Fumarola C, La MS, Guidotti GG. Aminosäuresignalisierung über das Säugetierziel des Rapamycin (mTOR) -Pfades: Rolle von Glutamin und Zellschrumpfung. J Cell Physiol 2005; 204: 155 & ndash; 65.
- Nicklin P., Bergman P., Zhang B., Triantafellow E., Wang H., Nyfeler B. et al. Der bidirektionale Transport von Aminosäuren reguliert mTOR und Autophagie. Cell 2009; 136: 521 & ndash; 34.
- Drummond MJ, Glynn EL, Fry CS, Timmerman KL, Volpi E, Rasmussen BB. Eine Erhöhung der Verfügbarkeit essentieller Aminosäuren reguliert die Aminosäuretransporterexpression im menschlichen Skelettmuskel. Am J Physiol Endocrinol Metab 2010; 298: E1011-E1018.
- Heublein S., Kazi S., Ogmundsdottir MH, Attwood EV, Kala S., Boyd CA, et al. Protonenunterstützte Aminosäuretransporter sind konservierte Regulatoren der Proliferation und der Aminosäureabhängigen Aktivierung von mTORC1. Oncogene 2010; 29: 4068 & ndash; 79.
- Baird FE, Bett KJ, MacLean C, Tee AR, Hundal HS, Taylor PM. Tertiärer aktiver Transport von Aminosäuren, die durch Koexpression von System A- und L-Transportern in Xenopus-Oozyten rekonstituiert wurden. Am J Physiol Endocrinol Metab 2009; 297: E822-E829.
- Hundal HS, Taylor PM. Aminosäuretranszeptoren: Gate Keeper des Nährstoffaustauschs und Regulatoren der Nährstoffsignalisierung. Am J Physiol Endocrinol Metab 2009; 296: E603 & ndash; E613.
- Hyde R, Taylor PM, Hundal HS. Aminosäuretransporter: Rolle bei der Erfassung und Signalübertragung von Aminosäuren in tierischen Zellen. Biochem J 2003; 373: 1 & ndash; 18.
- Newsholme EA, Calder PC. Die vorgeschlagene Rolle von Glutamin in einigen Zellen des Immunsystems und spekulative Konsequenzen für das gesamte Tier. Nutrition 1997; 13: 728 & ndash; 30.
- Ardawi MS, Newsholme EA. Maximale Aktivitäten einiger Enzyme der Glykolyse, des Tricarbonsäurezyklus und der Ketonkörper- und Glutaminverwertungswege in Lymphozyten der Ratte. Biochem J 1982; 208: 743 & ndash; 8.
- Agostini F, Biolo G. Einfluss körperlicher Aktivität auf den Glutaminstoffwechsel. Curr Opin Clin Nutr Metab Care 2010; 13: 58-64.
- Meilen MP, Naukam RJ, Hackney AC, Clarkson PM. Blutleukozyten- und Glutaminschwankungen nach exzentrischem Training. Int J Sports Med 1999; 20: 322 & ndash; 7.
- Walsh NP, Blannin AK, Clark AM, Cook L., Robson PJ, Gleeson M. Die Auswirkungen von hochintensivem intermittierendem Training auf die Plasmakonzentrationen von Glutamin und organischen Säuren. Eur J Appl Physiol Occup Physiol 1998; 77: 434 & ndash; 8.
- Darmaun D., Just B., Messing B., Rongier M., Thuillier F., Koziet J. et al. Glutaminstoffwechsel bei gesunden erwachsenen Männern: Reaktion auf enterale und intravenöse Ernährung. Am J Clin Nutr 1994; 59: 1395 & ndash; 402.
- Biolo G., De CM, Dal M., V., Lorenzon S., Antonione R., Ciocchi B. et al. Reaktion der Muskelprotein- und Glutaminkinetik auf verzweigtkettige angereicherte Aminosäuren bei Intensivpatienten nach einer radikalen Krebsoperation. Nutrition 2006; 22: 475 & ndash; 82.
- Darmaun D, Dechelotte P. Rolle von Leucin als Vorstufe von Glutamin-Alpha-Aminostickstoff in vivo beim Menschen. Am J Physiol 1991; 260: E326-E329.
- Hyde R, Peyrollier K, Hundal HS. Insulin fördert die Zelloberflächenrekrutierung des SAT2 / ATA2-Systems. Ein Aminosäuretransporter aus einem endosomalen Kompartiment in Skelettmuskelzellen. J Biol Chem 2002; 277: 13628 & ndash; 34.
- Vilsboll T, Holst JJ. Inkretine, Insulinsekretion und Typ-2-Diabetes mellitus. Diabetologia 2004; 47: 357 & ndash; 66.
- Evans K., Nasim Z., Brown J., Butler H., Kauser S., Varoqui H. et al. Die Acidose-Sensing-Glutaminpumpe SNAT2 bestimmt die Aminosäurespiegel und das Säugetierziel der Rapamycin-Signalübertragung zur Proteinsynthese in L6-Muskelzellen. J Am Soc Nephrol 2007; 18: 1426 & ndash; 36.
- Evans K., Nasim Z., Brown J., Clapp E., Amin A., Yang B. et al. Die Hemmung von SNAT2 durch metabolische Azidose verstärkt die Proteolyse im Skelettmuskel. J Am Soc Nephrol 2008; 19: 2119 & ndash; 29.



Bisher hat noch niemand einen Kommentar zu diesem Artikel abgegeben.